Sare Wikipedia - Wikipedia săruri carte - Informații de la Wikipedia pe hartă, gulliway
Sărurile - substanțe complexe care se disociază în cationi metalici și anioni ai anionilor în soluții apoase. IUPAC definește sare ca niște compuși chimici compuse din cationi și anioni. Există o altă definiție: Sărurile sunt substanțe care pot fi preparate prin reacția acidului si bazei cu eliminarea apei.
Mai mult decât atât cationii metalici în sărurile pot fi cationi de amoniu NH4. .. derivați de PH4 fosfoniu și cationii lor organice și complexe, etc. Anionii sărurilor sunt anionii din reziduuri de acid diferiți acizi Johannes Nicolaus Bronsted - atât anorganice și organice, inclusiv anioni și carbanioni complexe.
M. V. Lomonosov în lucrările sale chimie și fizică, a descris conceptul de „sare“:
nume săruri indică corpul fragil, care se dizolvă în apă, și rămâne limpede; ei nu se aprind în cazul în care pur expus la foc. felul lor: vitriol și orice altă sare metalică, alaun, borax, tartru, plante de sare semnificativă, sare, bitartrat de potasiu și potasiu, zbura sare uric, salpetru, primăvară comună sare, mare și piatră, săruri mirositoare, sare Epsom și alte săruri derivate ca urmare a unor lucrări chimice.
tipuri de sare
Dacă luăm în considerare sarea ca produsele de înlocuire de protoni cu acizi sau baze în gidroksogrupp, putem distinge următoarele tipuri de săruri:
- Valorile medii (normale) sare - produse de substituție ale cationilor de hidrogen de la moleculele de acid ale cationilor metalici (Na2 CO3 K3 PO4.).
- Sărurile acide - produsele de substituție parțială a hidrogenului cation în acizii cationilor metalici (NaHCO3 K2 HPO4.). Ele sunt formate prin neutralizarea acidului cu exces de bază (adică, într-o lipsă a unei baze sau acid în exces).
- Sărurile bazice - produse de substituție ale bazei gidroksogrupp incomplete (OH) reziduurile acide ((CuOH) 2 CO3). Ele sunt formate în condiții de exces de bază sau deficit de acid.
Conform numărului prezent în structura cationi și anioni ai următoarelor tipuri de săruri:
- Săruri simple - sare constând dintr-un singur tip de cationi și un singur tip de anion (NaCl)
- Săruri duble - săruri cu două cationi diferiți (KAl (SO4) 2 · 12 H2O).
- Sărurile mixte - săruri, în care structura este prezent doi anioni diferiți (Ca (OCI) Cl).
De asemenea, distinge săruri hidratate (hidrat cristalin), care includ molecule de apă de cristalizare, de exemplu, Na2 SO4 · 10 săruri H2O și complexe. conținând un cation complex sau anion complex (K4 [Fe (CN) 6], [Cu (NH3) 4] (OH) 2). Sărurile interne sunt formate cu ioni bipolare, adică molecule care conțin atât un atom încărcat pozitiv și încărcat negativ.
săruri Nomenclator
Sărurile Nomenclatură oxigenat
Sărurile Names sunt în general asociate cu numele acizilor corespunzători. Din moment ce mulți acizi sunt în nume triviale sau tradiționale românești, nume similare (nitrați, fosfați, carbonați, etc.) sunt stocate și săruri.
Numele tradiționale de săruri compuse din nume anioni în cazul nominativ și numele cationilor, în cazul genitiv. Numele anioni se bazează pe nume românești sau latine ale elementelor de acid. Dacă elementul care formează acid poate avea un grad de oxidare, se adaugă la -la nume de sufixe:
CO3 - carbonat, GEO3 - germanate.
Dacă elementul de acid formatoare poate lua două starea de oxidare, apoi un anion format în acest element într-o stare de oxidare mai mare, -la sufixul utilizat. și pentru anion cu elemente la un grad mai mic de oxidare - pentru -um sufix:
Dacă elementul are trei starea de oxidare, pentru sunt utilizate gradul superior, mijlociu și inferior de oxidare, respectiv sufixe -la. și sufixul -um -um cu hipo prefix -:
În cele din urmă, în cazul elementelor care iau stat patru oxidare pentru prefix de oxidare mai mare utilizat pen - și -cel sufix. de mai jos (în ordinea descrescătoare a oxidării stat) sufix -la. sufix și sufixul -um -um cu hipo prefix -:
ClO4 - perclorat, ClO3 - cloratul, ClO2 - clorit, ClO - Hipoclorit.
Prefixele meta -, orto -, poli -, di -, tri -, peroxo - .., etc sunt prezente în mod tradițional în denumirile de acizi, sunt de asemenea stocate în numele anionilor.
Nume Nume cationii corespund elementelor din care sunt formate: dacă numărul corespunzător indicat de atomi în cation (Dirtuti (2+ cation) Hg2 cation tetramyshyaka (2+) AS4.) Și gradul de oxidare, dacă este variabilă.
Nume săruri acide formate prin adaugarea prefixului hidro - Titlul anion. Dacă un anion are mai mult de un atom de hidrogen, cantitatea indicată prin intermediul consolelor multiplicatoare (NaHCO3 - bicarbonat de sodiu, NaH2 PO4 - fosfat diacid de sodiu). In mod similar, pentru a forma de bază denumirile de săruri utilizate prefixe hidroxo - ((FeOH) NO3 - gidroksonitrat de fier (II)).
Cristalin hidrat dă numele prin adăugarea cuvântului la hidratul convențional sau sare denumirea sistematică (Pb (BrO3) 2 · H2O - hidrat de plumb bromat (II), Na2 CO3 · 10 H2O - carbonat de sodiu decahidrat). Dacă se cunoaște structura cristalină, nomenclatura poate fi folosit compuși complecși ([Be (H2O) 4] SO4 - sulfat tetraakvaberilliya (II)).
Pentru anumite clase de săruri nume de grup existente, de exemplu, alaun - pentru dublu tip general MM sulfati (SO4) 2 · 12 H2O, unde M - cationi de sodiu, potasiu, rubidiu, cesiu, taliu sau amoniu, și M - cationi de aluminiu, galiu , indiu, taliu, titan, vanadiu, crom, mangan, fier, cobalt, rodiu sau iridiu.
Pentru mai multe săruri complexe sau rare utilizate denumiri sistematice sunt formate în conformitate cu regulile de nomenclatură a compușilor complecși. Conform acestei nomenclaturi, sarea este împărțită într-o sferă interioară (cation și anion) exterior și: acesta din urmă este compus dintr-un atom central și liganzi - atomii legați la atomul central. sare Titlul se formează după cum urmează. nume înregistrat inițial sferă interioară (anion) în cazul nominativ, constând din nume de liganzi (prefixe) și un element central (rădăcină) sufix -la și indicând gradul de oxidare. Apoi adăugați numele la numele sferei exterioare a atomilor (cationi) în cazul genitiv.
LiBO3 - trioksoborat (III) de litiu Na2 Cr2 O7 - geptaoksodihromat (VI) NaHSO4 sodiu - tetraoksosulfat (VI) hidrogen-sodiu
Sărurile acidului anoxice Nomenclatură
Pentru formarea sărurilor de nume anoxice sunt denumiri comune compilare reguli de compuși binari: aplica un regulile nomenclaturii universale care specifică prefixe numerice sau Tija care indică gradul de oxidare, cu a doua metodă fiind preferată.
Denumirile halogenuri sunt preparate din denumire halogen sufix -id și cationi (NaBr - bromură de sodiu, SF6 - fluorura de sulf (VI) sau hexafluorură de sulf, Nb6 I11 - geksaniobiya undekaiodid). Mai mult, există pseudohalogenură de clasă - săruri care conțin anioni cu proprietăți galogenidopodobnymi. Numele lor sunt formate în mod similar (Fe (CN) 2 - cianură de fier (II), AgNCS - tiocianat, argint (I)).
Chalcogenides. care conține ca anion sulf, seleniu și telur, numit sulfuri seleniurile și telururi. Hidrogen sulfurat și Seleniură pot forma săruri de adiție acidă, care sunt numite iiidrosulfură respectiv gidroselenidami și (ZnS - sulfură de zinc, SiS2 - bisulfura de siliciu, NaHS - hidrosulfură). Sulfurile duble numit arătând două cationi hyphenated: (FeCu) S2 - disulfura, cupru-fier.
Proprietățile fizice și structura sărurilor
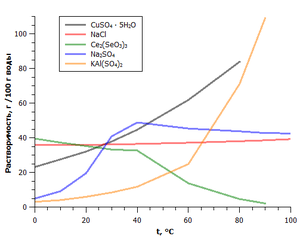
Dependența solubilității unor săruri ale temperaturii
În general, sărurile sunt substanțe cristaline cu rețea cristalină de ioni. De exemplu, cristalele de halogenuri ale metalelor alcaline și alcalino-pământoase (NaCl, CsCl, CaF2) construite din anioni situate pe principiul densest ambalare sferic, și cationi care ocupă golurile în ambalaj. cristalele de sare ionici pot fi construite din reziduurile acide combinate în fragmente anionice interminabile și schele tridimensionale cu cationi în cavități (silicați). Această structură reflectă în mod adecvat în proprietățile lor fizice: acestea au puncte de topire ridicate, în stare solidă sunt izolatoare.
De asemenea, cunoscut (covalente) structura molecular de sare (de exemplu, clorură de aluminiu AICI3). Multe săruri ale naturii legăturilor chimice este intermediară între ionică și covalentă.
De interes particular sunt lichide ionice - săruri cu puncte de topire sub 100 ° C Mai mult de temperatura de topire anormale de lichide ionice au practic zero, presiunea de vapori și vâscozitate ridicată. Proprietățile speciale ale acestor săruri sunt explicate printr-un cation simetrie scăzută, interacțiunea slabă dintre ioni și bine cation distribuție de sarcină.
O proprietate importantă a sărurilor este solubilitatea lor în apă. Prin acest criteriu secreta săruri solubile, puțin solubile și insolubile.
Fiind în natură
metode de preparare
Există diferite metode de preparare a sărurilor:
- Acizi de interacțiune cu metale, oxizi / hidroxizi de bază și amfoteri:
H 2 S O 4 + M g ⟶ M g S O 4 + H 2 ↑ + Mg \ longrightarrow MgSO_ \ upArrow >>>
H 2 S O 4 + M g O ⟶ M g S O 4 + H 2 O + MgO \ longrightarrow MgSO_O >>>
3 H 2 S O 4 + A l 2 O 3 ⟶ A l 2 (S O 4) 3 + 3 H2O + Al_ \ longrightarrow Al _) _ O >>>
- Interacțiunea dintre oxizi acizi c alcaline, oxizi / hidroxizi de bază și amfoteri:
C o O + S i O 2 ⟶ C o S i O 3 \ longrightarrow casio _ >>
O l 2 O 3 + 3 S O 3 ⟶ A l 2 (S O 4) 3 \ longrightarrow Al _) _ >>
- Interacțiunea c acizi săruri, alte săruri (formate la ieșirea din produsul de reacție):
C o C O 3 + 2 H C l ⟶ C o C l 2 + H 2 O + C O 2 ↑ + 2HCl \ longrightarrow CaCl_O + CO_ \ upArrow >>>
C u C l 2 2 + N o S ⟶ 2 N o C l + C u S ↓ + Na_S \ longrightarrow 2NaCI + CuS \ downarrow >>>
- Interacțiunea substanțelor simplu:
- Interacțiunea cu baze nemetale, de exemplu, cu halogeni:
C o (O H) 2 + C l 2 ⟶ C o (O C l) C l + H 2 O + Cl_ \ longrightarrow Ca (OCI) Cl + H _ >>
hidrații de cristal sunt de obicei obținute prin cristalizarea sărurilor din soluții apoase, dar, de asemenea, cunoscut săruri solvați de cristal, care se încadrează din solvenți apoși (de exemplu, CaBr2 · 3 C2 H5 OH).
chimice
Proprietățile chimice sunt determinate de proprietățile cationi și anioni în cadrul acestora.
Sărurile reacționează cu acizi și baze, dacă se obține produsul de reacție, care iese din reacție (substanța malodissotsiiruyuschie gaz precipitat cum ar fi apa):
B o C l 2 + H 2 S O 4 ⟶ B A S O 4 ↓ + 2 H C l \ longrightarrow BaSO_ \ downarrow + 2HCl >>>
N o H C O 3 + H C l ⟶ N o C l + H 2 O + C O 2 ↑ + HCI \ longrightarrow NaCl + H_ \ upArrow >>>
N a 2 S i O 2 + 3 H C l ⟶ 2 N o C l + H 2 S i O 3 ↓ + SiO_ 2HCl \ longrightarrow 2NaCI + H_SiO_ \ downarrow >>>
Sărurile reacționează cu metalele dacă metalul este lăsat liber de săruri metalice alcătuite din metale în activitatea seria electrochimică:
C u + H g C l 2 ⟶ C u C l 2 + H g \ longrightarrow CuCl _ >>
Sărurile interacționează unele cu altele, în cazul în care produsul de reacție iese din zona de reacție (precipitatul format gaz sau apă); inclusiv aceste reacții pot avea loc cu gradele de schimbare ale reactanților de oxidare atomi:
C o C l 2 + N o 2 C O 3 ⟶ C o C O 3 ↓ + 2 N o C l + Na_ \ longrightarrow CaCO_ \ downarrow + 2NaCI >>>
O g N O 3 + N o C l ⟶ A g C l ↓ + N o N O 3 + NaCl \ longrightarrow AgCl \ downarrow + NaNO _ >>
K 2 C r 2 O 7 + 3 N a 2 SO 3 + 4 H 2 SO 4 ⟶ C r 2 (SO 4) 3 + 3 N a 2 SO 4 + K 2 SO 4 + 4 H 2 O + 3Na_ + K_ + 4H _ >>
Unele săruri se descompun la încălzire:
C u C O 3 ⟶ C u O + C O 2 ↑ \ longrightarrow CuO + CO_ \ upArrow >>>
4 N H N O 3 ⟶ N 2 O ↑ + 2 H 2 O \ longrightarrow N_O \ upArrow + 2H _ >>
4 N H N O 2 ⟶ N 2 ↑ + 2 H 2 O \ longrightarrow N_ \ upArrow + 2H _ >>
Disocierea în soluții apoase
disociază complet sau parțial în ioni când se dizolvă în apă sărată. Dacă disociere se produce în mod egal, sărurile sunt electroliți puternici, sau - slab. Un exemplu de electroliți tipic puternice pot fi săruri ale metalelor alcaline care există ca ioni de solvate în soluție. În ciuda faptului că teoria larg răspândită, care afirmă că sărurile disociază în soluție apoasă complet, în realitate, pentru cele mai multe săruri, există parțial disociere, de exemplu, soluție 0,1 M FeCl3 conține doar 10% din cationi de Fe, iar 42% dintre cationii FeCh, 40% dintre cationii FeCl2. Cationii FeOH 6% și 2% cationilor Fe (OH) 2.
săruri Hidroliza
Anumite săruri în soluții apoase sunt capabile de a suferi hidroliză. Această reacție este reversibilă pentru sărurile slab acide (Na2 CO3) sau baze slabe (CuCI2) și ireversibil - pentru sărurile acizilor slabi si baze slabe (Al2 S3).