Tabelul periodic al elementelor chimice Leeuw
În natură, există o mulțime de secvențe repetitive:
- anotimpuri;
- ora din zi;
- zile ale săptămânii ...
La mijlocul secolului al 19-lea, Mendeleev a observat că proprietățile chimice ale elementelor au, de asemenea, o anumită secvență (spun ideea a venit la el într-un vis). Rezultatul minunatul vis al omului de știință a devenit tabelul periodic al elementelor chimice, în care DI Mendeleev construite elemente chimice în creșterea masei atomice. În elemente moderne de masă chimice sunt aranjate în creșterea numărului atomic (numărul de protoni din nucleul atomului).
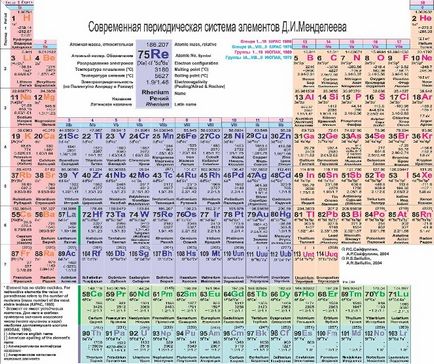
Numărul atomic este indicat pe simbolul chimic, un simbol - greutatea atomică (suma de protoni și neutroni). Rețineți că greutatea atomică a unor elemente care nu este un număr întreg! Amintiți-vă izotopi! masa atomică - este media ponderată a tuturor izotopii unui element în mod natural în natură.

Sub tabel sunt situate lantanide și actinide.
Perioadele de linie orizontale ale tabelului periodic menționat.
Perioadele sunt numerotate de la 1 la 7.
Coloanele verticale ale tabelului periodic menționat grupe (familii).
Pentru grupurile de numerotare aplicat inițial cifre romane și litere (IA, IIA, IIIB ...). Acum, pentru a descrie grupurile folosind un număr de 1-18.
1. Metale metaloizi, nemetale
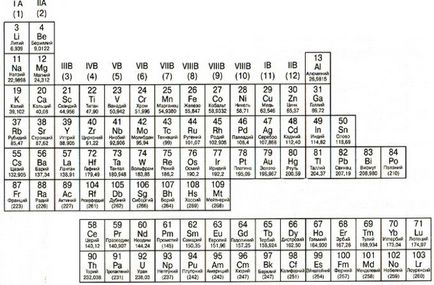
Metalele sunt aranjate în tabelul periodic din partea stângă a liniei diagonale în trepte care începe cu Bora (B) și se termină poloniu (Po) (cu excepția germaniu (Ge) și antimoniu (Sb). Este ușor de văzut că metalele ocupă cea mai mare parte a tabelului periodic. Proprietățile principale metale: solide (cu excepția mercurului); strălucire; bun conductor electric și căldură, din plastic, maleabile, donează electroni cu ușurință.
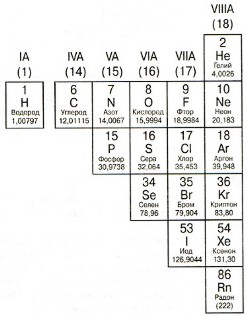
Elemente de dreapta diagonală etapa B-Po, numit nemetale. Proprietățile nemetalelor sunt direct opuse proprietăți metalice: conductoarele slabe de căldură și electricitate; fragilă; neductil; non-plastic; de obicei, accepta electroni.
metaloizi
semi-metale (metaloizi) situate între metale și nemetale. Ele sunt caracterizate prin proprietățile ambelor metale și nemetale. Cererea principal în industria de semi-metale găsite în industria de semiconductori, fără de care nici un cip modern sau microprocesor.
2. Perioadele și grupuri
După cum sa menționat mai sus, tabelul periodic este împărțit în șapte perioade. În fiecare perioadă, numerele atomice ale elementelor crește de la stânga la dreapta.
Proprietățile elementelor din perioadele variază secvențial de sodiu (Na) și magneziu (Mg), situat la începutul celei de a treia perioadă dona electroni (Na da un electron: 1s 2 2s 2 2p 6 3s 1; Mg pierde doi electroni: 1s 2 2s 2 2p 6 3s 2). Dar, clor (CI), situat la sfârșitul perioadei, primește un element: 1s 2s 2 2 2 2p 6 3s 3p 5.
Proprietățile elementelor chimice din cadrul unei perioade sunt diferite.
În grupuri, dimpotrivă, toate elementele au aceleași proprietăți. De exemplu, în grupul IA (1) toate elementele de litiu (Li) și se încheie franciu (Fr), este dat un electron. Și toate elementele grupului VIIA (17) care primesc un element.
Unele grupuri sunt atât de importante pe care le-au primit nume speciale. Aceste grupuri sunt discutate mai jos.
3. Metale
Grupul IA (1). Atomii elementelor acestui grup sunt în stratul de electroni exterior doar un singur electron, deci da cu ușurință un electron.
Cele mai importante metale alcaline - sodiu (Na) și potasiu (K), deoarece acestea joacă un rol important în viața umană și sunt o parte a sărurilor.
4. Metale alcalino-pământoase
Grupa IIA (2). Atomii elementelor acestui grup sunt în stratul electronic exterior a doi electroni, care este, de asemenea, dat în timpul reacțiilor chimice. Cel mai important element - calciu (Ca) - baza oaselor si a dintilor.
5. Halogenii
VIIA Group (17). Atomii elementelor acestui grup sunt în general preparați de un electron, deoarece pe stratul exterior de electroni este pe cele cinci elemente și la „set complet“ lipsește doar un singur electron.
Cele mai cunoscute membrii acestui grup: clor (Cl) - o parte din săruri și înălbitor; Iod (I) - un element care joacă un rol important în tiroida umană.
6. inert gaz (nobil)
VIII Grup (18). Atomii elementelor din grupurile au complet strat „echipaj“ electron exterior. De aceea, ei „nu“ accepta electroni. Și să le dea ceea ce ei „nu doresc“. De aici - elementele acestui grup este foarte „greu“ intră în reacții chimice. Multă vreme sa crezut că în general ei nu reacționează (de aici termenul „inert“, adică „inactivă“). Dar chimist Neil Bartlett a descoperit că unele dintre aceste gaze, în anumite condiții, pot reacționa în continuare cu alte elemente.
- Ne - 1s 2s 2 2 2p 6;
- Ar - 1s 2s 2 2 2 2p 6 3s 3p 6;
- Kr - 1s 2s 2 2 2p 6 3s 2 3p 6 2 4s 3d 4p 10 6
7. Elementele de intindere ale Grupului
Este ușor de văzut că în cadrul fiecărui grup de elemente similare între ele cu electronii de valență (electronii s și p-orbitali dispuse pe nivelul energetic exterior).
În metal alcalin - 1 valență de electroni:
La metalele alcalino-pământoase - 2 electroni de valență:
În halogeni - 7 electroni de valență:
- F - 1s s 2 luna februarie 02 februarie p 5;
- Cl - 1s 2s 2 2 2p 6 Martie Martie 2 s p 5;
- Br - 1s 2s 2 2 2 2p 6 3s 3p 04 iunie s 2 p 3d 10 5 april
La inertelor - 8 electroni de valență:
- Ne - 1s s 02 februarie 02 februarie p 6;
- Ar - 1s 2s 2 2 2p 6 Martie Martie 2 s p 6;
- Kr - 1s 2s 2 2 2 2p 6 3s 3p 04 iunie s 2 p 3d 10 aprilie 06
numărul coloana roman al grupului - este numărul de electroni de valență în toate elementele grupului.
Să ne îndreptăm acum atenția către elementele aranjate în grupe de caractere B. Acestea sunt situate în centrul tabelului periodic se numesc metale de tranziție.
Caracteristica distinctivă a acestor elemente este prezența electronilor în atomi, umplutură d-orbitali:
- Sc - 1s 2s 2 2 2 2p 6 3s 3p 6 4s 2 3d 1;
- Ti - 1s 2s 2 2 2 2p 6 3s 3p 6 4s 2 3d 2
În afară de tabelul de bază sunt lantanide și actinide - așa-numitele metale de tranziție interioare. In atomii acestor elemente electroni umple f-orbitali:
- Ce - 1s 2s 2 2 2 2p 6 3s 3p 6 4s 2 4p 6 3d 10 4d 10 5s 5p 2 4f 6 5d 1 1 6s 2;
- Th - 1s 2s 2 2 2 2p 6 3s 3p 6 4s 2 4p 6 3d 10 4d 10 5s 5p 2 4f 6 5d 14 10 6s 2 6p 6 6d 2 7s 2