Tabelul periodic al elementelor
Sistemul periodic al elementelor chimice (tabelul periodic) - clasificarea elementelor chimice. stabilirea unei dependențe de proprietăți diferite ale elementelor încărcăturii nucleului atomic. Sistemul este o expresie grafică a legii periodice. stabilit de chimist român D. I. Mendeleevym în 1869. Versiunea inițială a fost dezvoltată D. I. Mendeleevym în anii 1869-1871 și a stabilit dependența proprietăților elementelor din greutatea lor atomic (într-un mod modern, de masa atomică). Total propuse câteva sute [1] imaginea concretizările periodice ale sistemului (curbe analitice, tabele, figuri geometrice și așa mai departe. P.). In prezentul exemplu de realizare, sistemul presupune elementele de reducere într-un tabel bidimensional în care fiecare coloană (grup) definește proprietățile fizice și chimice de bază, iar rândurile reprezintă perioade. într-o anumită măsură asemănătoare între ele.

Conform legendei, ideea elementelor chimice ale sistemului ajuns la Mendeleev în somn, dar știm că, odată întrebarea cum a descoperit sistemul periodic, omul de știință a spus, „Sunt peste el, sau poate doar douăzeci de ani de gândire, și credeți că: ședință și dintr-o dată ... gata. "
Scrierea pe carduri proprietățile de bază ale fiecărui element (care la acel moment era cunoscut la 63, dintre care unul - Didim Di - sa dovedit, în viitor, cu un amestec format din două elemente nou descoperite praseodim și neodim), Mendeleev incepe sa repetat rearanja aceste carduri, fac o serie de proprietăți similare elemente se potrivesc serie unul cu altul [3]. Lucrarea a fost trimisă în 1869 la instituțiile academice din România și alte țări, prima versiune a sistemului ( „Experiența a elementelor, în funcție de greutatea lor atomică și similaritatea chimică“), în care elementele au fost plasate pe nouăsprezece rânduri orizontale (rânduri de elemente similare care au devenit prototipuri grupuri de sistem modern) și șase coloane verticale (prototipul perioadelor viitoare). In 1870 godu versiune a doilea sistem ( „sistem natural al elementelor“) Mendeleev în „Bazele Chemistry“ a publicat, având o formă familiară ne: coloane orizontale elemente analogice transformat în opt grupuri de dispuse vertical; șase coloane verticale a devenit primul exemplu de realizare, în perioadele care încep și se termină cu un halogen de metal alcalin. Fiecare perioadă a fost împărțită în două serii; diferite elemente incluse în grupul format din seria subgrupe.

Coperta broșurii „Încercarea de a înțelege eterul chimic mondial“ și tabelul periodic al elementelor din ea (Muzeul Tehnic, București, 1902 ediția a)
Esența descoperirii lui Mendeleev a fost faptul că, odată cu creșterea în greutate atomică a elementelor chimice ale proprietăților lor nu se schimbă monoton, dar din când în când. După un anumit număr de diferite proprietăți ale elementelor aranjate în creșterea greutății atomice, proprietatile incep sa se repete. De exemplu, sodiu este similar cu potasiu. similar cu fluor clor. și aur ca argint și cupru. Desigur, proprietățile nu se repetă exact, se adaugă la ele, și de a schimba. Cu lucrarea lui Mendeleev lucru de la predecesorii săi a fost că bazele pentru clasificarea elementelor Mendeleev nu a fost una, ci două - greutatea atomică și similaritatea chimică. Pentru a PERIODICITY respectate pe deplin, Mendeleev au fost luate măsuri foarte îndrăznețe a corectat greutățile atomice ale unor elemente (de exemplu, beriliu, toriu uraniu indiu, ceriu titan ytriu ......), Mai multe articole postate în sistemul contrar la acceptat în timp ce reprezentări ale asemănării lor cu celălalt (de exemplu, taliu. a fost considerat un metal alcalin, este plasat în al treilea grup în funcție de valența maximă reală), stânga celule goale în tabel, în cazul în care ar fi trebuit să rămână deschise până la elementele . În 1871, pe baza acestei lucrări Mendeleev a formulat legea periodică. care în cele din urmă formă a fost oarecum îmbunătățită.
Precizia științifică a legii periodice a fost confirmată foarte curând: în 1875 -1886 ani au fost descoperite galiu (EKA-aluminiu), scandiu (ekabor) și germaniu (ekasilitsy) pentru care Mendeleev, profitând sistemului periodic, a prezis nu numai posibilitatea existenței lor, dar, de asemenea, cu izbitoare acuratețe a descris o serie de proprietăți fizice și chimice.
La începutul secolului XX, sa constatat că proprietățile de frecvență schimba elemente nu este determinată greutatea atomică, și o sarcină nucleară deschidere structurii atomice. egal cu numărul atomic și numărul de electroni, care sunt distribuite de-a lungul cojile de electroni ale atomilor elementului determină proprietățile chimice ale acesteia.
Elementele 115 și 117 au primit numele de leșești (Mc) și tennessin (Ts), în conformitate cu propunerile JINR, si Oak Ridge National Laboratory, Universitatea Vanderbilt si Lawrence Livermore National Laboratory din Statele Unite.
Cele mai frecvente sunt 3 forme ale tabelului periodic, „scurt“ (perioadă scurtă), „lung“ (de lungă perioadă) și „super-lung.“ Versiunea „Ultra lung“ a fiecărei perioade durează exact o singură linie. Lantanide „lungi“ varianta si de actinide eliminate din tabelul comun, făcându-l mai compact. Forma „scurt“, a înregistrării, în plus față de aceasta, a patra și a perioadelor ulterioare ocupate de 2 linii; simboluri ale elementelor principale și subgrupe de margini sunt aliniate în raport cu diferite celule. Hidrogenul este uneori plasat într-un 7-lea (forma „scurtă“) sau 17-lea (forma „lung“) tabel grup [5] [6].
Mai jos este o versiune mai lungă (formă lungă perioadă) aprobat de Uniunea Internațională de Chimie Pură și Aplicată (IUPAC) ca nucleu.
Tabelul periodic al elementelor
Forma scurtă a tabelului. care cuprinde opt grupe de elemente [7]. IUPAC oficial abolit în 1989. În ciuda recomandarea de a utiliza formularul lung, scurt formular continuă să fie condus într-un număr mare de manuale și manuale românești, și după această dată. Din literatura străină formă scurtă modernă este exclusă complet, în loc să-l folosește forma lungă. O situație unii cercetători leagă inclusiv o compactitatea rațională aparentă a formei scurte a mesei, precum și inerția, gândirea stereotipă și non-percepție a informațiilor moderne (internaționale) [8].
În 1970, Teodor Siborg a propus tabelul periodic extins. Niels Bohr a dezvoltat scara de formă (piramidal) a sistemului periodic. Există multe alte, utilizate rar sau nu, ci mai degrabă original, moduri de a afișa grafic Legea periodic [9] [10]. Astăzi, există sute de opțiuni pentru tabel, oamenii de stiinta sugereaza toate noile opțiuni. [11]
Grupuri permisiune
Grup sau familie - una din coloanele din tabelul periodic. Pentru grupurile de obicei caracterizate printr-o tendință substanțial periodic exprimate decât pentru perioade sau blocuri. Teoria modernă cuantică a structurii atomice explica grup comun în care elementele din cadrul aceluiași grup au, în general configurații electronice similare în cochiliile de valență. [12] Prin urmare, elementele care aparțin aceluiași grup au în mod tradițional proprietăți chimice similare și demonstrează un model clar de modificare a proprietăților odată cu creșterea numărului atomic [13]. Cu toate acestea, în unele zone din tabel, de exemplu - în d-bloc și f-bloc Similaritatea orizontale pot fi la fel de important sau chiar exprimat mai accentuat decât cea verticală [14] [15] [16].
În conformitate cu sistemul internațional de grupuri de denumire sunt numerotate 1 la 18 de la stânga la dreapta - de metal alcalin la gazul nobil [17]. Anterior, identificarea lor folosite cifre romane. În practică, după cifrele romane americane reprezentate ca litera A (în cazul în care gruparea situată în s-p-bloc sau bloc) sau B (în cazul în care un grup a fost în d-bloc). Apoi, aplicat identificatori corespund ultimei cifre a indicatorilor numerici moderni - de exemplu, elemente din grupa 4 corespunde numelui IVB, iar cei care sunt acum cunoscute ca un grup de 14 - IVA. Un sistem similar a fost folosit în Europa, cu excepția faptului că litera A se referă la gruparea până la a zecea, și în - grupuri, deoarece a zecea inclusiv. Grupe 8, 9 și 10, în plus, este adesea considerată ca fiind un triplu identificator de grup VIII. În 1988 a intrat în vigoare un nou sistem de notație a IUPAC. foști și numele grupurilor din uz [18].
Unele dintre aceste grupuri au fost atribuit, denumirea trivială nesistematice (de exemplu, „metale alcalino-pământoase“, „halogen“, etc ...); Cu toate acestea, unele dintre ele sunt rar folosite. Grupuri de trei prin paisprezecea, inclusiv, aceste denumiri nu au, și ele sunt identificate fie prin număr sau nume de prim membru ( „titan“, „cobalt“, și așa mai departe), deoarece acestea prezintă un grad mai scăzut de similitudine între ele sau respectarea minimă pe verticală regularități [17].
Elementele care aparțin aceluiași grup au tendința de a arăta anumite tendințe în raza atomică. energia de ionizare și electronegativitate. De sus în jos în interiorul atomului grupului crește raza (mai mult el umplut nivelurile de energie, electronii de valență mai departe de nucleu sunt aranjate) și scade energia de ionizare (în atom slăbește, și, prin urmare, să se retragă de electroni devine mai ușoară), precum și electronegativitate (care, la rândul său, a determinat o creștere a distanței dintre electronii de valență și nucleul) [19]. Happen, cu toate acestea, sunt excepții de la aceste modele - de exemplu, în grupul 11 în direcția în jos electronegativitate crește și nu scade [20].
perioadele Editare
Perioada - rând din tabelul periodic. Deși grupele menționate anterior, se caracterizează prin mai multe tendințe și modele semnificative, există, de asemenea, o regiune în care direcția orizontală este mai importantă și semnificativă decât cea verticală - de exemplu, acest lucru se aplică f-bloc, unde lantanide și actinide formează două elemente importante ale secvenței orizontale [ 21].
În perioada elementelor prezintă anumite regularități în cele trei aspecte menționate mai sus (raza atomică, electronegativitate și energia de ionizare), iar energia afinității de electroni. De la stânga la raza atomică dreapta de obicei redusă (datorită faptului că fiecare element ulterior crește numărul de particule si electroni incarcate sunt atrase mai aproape de nucleul [22]), iar energia creste ionizare în paralel cu ele (cu atât mai puternică legătura la atomul, cu atât mai mult energia este necesară pentru electroni de retragere). crescând Corespunzător electronegativitate și [19]. În ceea ce privește afinitatea de electroni, metalele din partea stângă a tabelului sunt caracterizate printr-o valoare mai mică a acestui indice, iar în dreapta nemetale corespunzător de mari - cu excepția gazelor nobile [23].
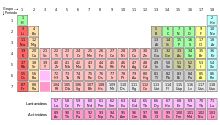
blocuri Editare
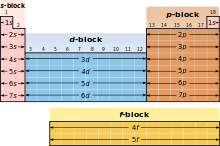
Diagrama bloc din Tabelul periodic
Având în vedere importanța coajă de electroni exterioare diferite zone ale atomului Tabelul periodic sunt uneori descrise ca blocuri, menționate în conformitate cu ordinea în care shell-ul este ultimul electron [24]. S-bloc include primele două grupuri. adică metalele alcaline și alcalino-pământoase, precum hidrogen si heliu; p-bloc este format din ultimele șase grupuri (13 la 18 în conformitate cu standardul de denumire IUPAC sau IIIA VUIA sistemului american) și include, printre alte elemente, toate metaloizi. D-bloc - un grup cu 3 până la 12 (IUPAC), ele - IIIB IIB cu americanul, care includ toate metalele de tranziție. F-bloc. suportabil, de obicei, în afara mesei, constând din lantanide și actinide. [25]
Alte modele periodice Editare
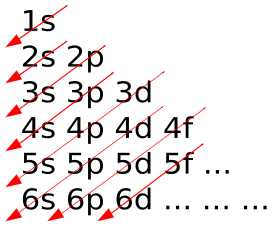
ordinea aproximativă, în conformitate cu articolul Madelung.
În afară de cele de mai sus, legea periodică și să respecte anumite alte caracteristici ale elementelor:
- configurația electronică. organizație electroni demonstrează anumit model care se repetă periodic. Electronii ocupă coji de secvențe, care sunt identificate prin numere (teaca 1, mantaua 2 și t. D.), iar cei din rândul lor, sunt compuse din subnivele, definite prin literele s, p, d, f și g. Pe măsură ce numărul atomic de electroni umple treptat carcasa; de fiecare dată când un electron ia un nou shell pentru prima dată, o nouă perioadă începe în tabel. Similarități în configurația electronică determină similitudinea dintre proprietățile elementelor (observația că, de fapt, a dus la descoperirea legii periodice) [26] [27].
- Metalicitate / nemetallichnost. Prin scăderea elementelor indicatorilor energetici ionizarea electronegativitate și energie afinitate de electroni dobândesc caracteristicile unui metal, și pe măsură ce cresc - dimpotrivă, pentru nemetale [28]. În conformitate cu legile pentru caracteristicile menționate mai sus, metalele cele mai pronunțate sunt situate într-o perioadă timpurie, și nemetale - la capătul său. În grupuri, pe de altă parte, așa cum se mută de sus în proprietăți metalice de fund crește, deși cu unele excepții de la regula generală. Combinația de modele orizontale și verticale conferă linie de demarcație condiționate între metale și nemetale formă în trepte; de-a lungul acestei linii elemente sunt uneori definite ca metaloizi [29] [30].

Proprietățile elementelor. Săgețile indică în creștere.
Tabelul periodic al DI Mendeleev a fost o piatră de hotar în dezvoltarea teoriei atomo-moleculare. Datorita acestui fapt, un concept modern al elementului chimic. A fost rafinat noțiunile de substanțe simple și compuși.
Rolul predictiv al sistemului periodic, așa cum se arată de mai Mendeleev, în secolul XX sa manifestat în evaluarea proprietăților chimice ale elementelor transuranice.
Dezvoltat în secolul al XIX-lea. în știința chimiei. tabelul periodic a fost ordonare terminat de atomi tipuri pentru noi ramuri ale fizicii. au dezvoltat în secolul al XX-lea. - fizica atomului si fizica nucleara. În cercetarea atom metode de fizica, sa constatat că numărul de ordine al elementului din tabelul periodic, numit, de asemenea, o serie de elemente. (Număr atomic) este o măsură a sarcinii electrice a miezului atomic al acestui element, numărul rând orizontal (perioada) în tabel determină numărul de cochilii de electroni de atomi. iar numărul de rânduri verticale - structura cuantică a carcasei superioare, care sunt necesare elemente și această serie similitudine proprietăți chimice.
Apariția sistemului periodic și descoperirea legii periodice a deschis o eră nouă, cu adevărat științifice în istoria chimiei și un număr de discipline conexe - în loc de informații împrăștiate despre elementele și compușii, D. I. Mendeleevym și adepții săi au creat un sistem armonios, pe baza cărora a devenit posibilă generalizarea, trage concluzii, prevăd.