Calculele în prepararea soluțiilor apoase de
Soluții aproximative. La prepararea soluțiilor de cantități aproximative de substanțe care trebuie luate pentru aceasta, calculată cu precizie mică. Ponderile atomice ale elementelor pentru a simplifica calculele au permis să ia rotunjit la unități întregi uneori. Astfel, pentru numărarea aspră greutatea atomică a fierului poate fi luată ca 56 în locul exact -55.847; sulf - 32 în loc de exact 32.064, etc ...
Substanțe pentru a face soluții aproximative sau technochemical cântărite pe echilibrul tehnic.
Fundamental calcule pentru prepararea soluțiilor sunt identice pentru toate substanțele.
Cantitatea soluției este preparată sau este exprimată în unități de masă (g kg), sau în unități de volum (ml, n), și pentru fiecare dintre aceste cazuri, calcularea cantității de substanță dizolvată este realizată în mod diferit.
Exemplu. Să presupunem că este necesar să se pregătească 1,5 kg de soluție de clorură de sodiu 15%; precalculați sarea Cantitate-TION include necesare acestora. Calculul se realizează în conformitate cu raportul:
t. e. când 100 g de soluție conține 15 g de sare (15%), cât de mult este necesar pentru a prepara o soluție de 1500 g?
Calculele arată că este necesar să se cântărească 225 grame de sare, apoi ia apă iuzhio 1500-225 = 1275 |
Dacă este setat pentru a obține 1,5 litri de aceeași soluție, în acest caz, directorul va ști densitatea sa este multiplicat în ultimul volum predeterminat și, astfel, în greutate sunt necesare cantități de soluție. Astfel, densitatea -noro 15% soluție de clorură de sodiu la 15 0C egală cu 1,184 g / cm3. Astfel, 1500 ml
Prin urmare, cantitatea de substanță pentru prepararea de 1,5 kg și 1,5 litri de soluție variază.
Calculul prezentat mai sus se aplică numai pentru prepararea soluțiilor anhidre de substanțe. Dacă luați o sare de apă, cum ar fi Na2SO4-IOH2O1 calculul este modificat oarecum, așa cum este necesar să se ia în considerare apa de cristalizare.
Exemplu. Să presupunem că este necesar să se pregătească 2 kg de soluție Na2SO4 10%, bazată pe Na2SO4 * 10H2O.
Greutatea moleculară este 142.041 Na2SO4, Na2SO4 * 10H2O o 322.195, 322.20 sau rotunjite.
Calculul sunt sare anhidră primul pas:
Prin urmare, este necesar să se ia 200 g de sare anhidră. săruri Numărul Decahidratul se găsesc din calcul:
Deoarece soluția nu pregătită întotdeauna cu conversie la sare anhidră pe etichetă, care în mod necesar trebuie să se lipească de vasul cu soluția, este necesar să se specifice din care soluția de sare a fost preparată, de exemplu, soluție Na2SO4 10% sau Na2SO4 25% * 10H2O.
Se întâmplă adesea că soluția preparată anterior trebuie diluată, adică pentru a reduce concentrația acestuia ..; soluții diluate sau volum sau greutate.
Putem calcula acum cât de mult să ia 20% * curse creează, pentru a da 2 litri de soluție de 5%.
Soluția rezultată poate conta pe greutatea volumului său. La această greutate soluție împărțită la densitatea sa (densitatea soluției este de 20% 1.1149 g / cm3), t. E.
În cazul în care diluarea efectuată în greutate, calculul este simplificată. Dar, în general, diluarea se realizează pe baza volumului, ca fluid, mai ales în cantități mari, este mai ușor să se măsoare în termeni de volum decât greutatea.
Trebuie să ne amintim că la fiecare loc de muncă ca dizolvarea și diluarea nu ar trebui să fie turnat dintr-o dată toată apa din vas. Clătit de mai multe ori cu apă vasele, care a fost efectuat cântărirea sau dozarea substanței dorite, și de fiecare dată când apa a fost adăugată la soluția de vas.
În cazul în care nu necesită soluții speciale de precizie la diluarea sau amestecarea acestora pentru a obține soluții de diferite concentrații pot utiliza următorul mod simplu și rapid.
Ia cazul diluției deja analizat de soluție de sulfat de amoniu 20% la 5%. Scrierea la început, după cum urmează:
în care 20 - soluție luată de concentrație 0 - Apă și 5 „- concentrația necesară. Acum ne scade 20 din 5 și scrie valoarea obținută în colțul din dreapta jos al scăzând din 5 la zero, scrie cifre în colțul din dreapta sus. Apoi, sistemul va arăta astfel:
Acest lucru înseamnă că este necesar să se ia 5 volume de soluție 20% și 15 volume de apă. Desigur, acest calcul nu diferă de precizie.
Dacă două soluții sunt amestecate una și aceeași substanță, circuitul persistă aceeași, schimbarea numai valori numerice. Lăsați amestecarea soluție 35% și 15% rezistență necesară pentru a prepara o soluție de 25%. Apoi, sistemul va arăta astfel:
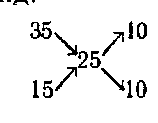
t. e. trebuie să ia până la 10 volume ale celor două soluții. Acest sistem oferă rezultate aproximative și poate fi folosit numai atunci când precizia specială nu este trebuetsya.Dlya fiecare chimist este foarte important pentru a cultiva obiceiul de precizie în calcule atunci când este necesar, și să utilizeze numere aproximative, în cazul în care aceasta nu afectează rezultatele raboty.Kogda nevoie de mai multă precizie într-o soluție diluată, calculul se efectuează formule.
Să luăm în considerare câteva cazuri importante.
Prepararea unei soluții diluate. Să c - cantitatea de soluție, m% -concentration soluție care trebuie diluate până la o concentrație de n%. Care rezultă diluat cantitate soluția x se calculează cu formula:
și apa pentru diluare volum din soluția se calculează cu formula:
Amestecarea celor două soluții ale aceleași substanțe de concentrații diferite pentru a obține concentrația dorită de soluție. Să amestecare piese și soluție m% cu x părți n% soluție necesară pentru a obține /% - soluție a fost apoi:
Soluții exacte. Pentru prepararea soluțiilor, calcularea exactă a cantităților de verificare de substanțe dorite au un grad de precizie suficient. Echilibrele atomice luate din tabel, care arată valorile lor exacte. La adăugarea (sau scăderea) sunt de valoare pe termen exacte cu cel mai mic număr de zecimale. Termenii rămase sunt rotunjite, lăsând după virgulă un semn mai mult decât în termenul cu cel mai mic număr de caractere. Ca urmare, mulți dintre aceștia zecimale, deoarece există în termen cu cel mai mic număr de zecimale; în același timp, produc rotunjirii necesară. Toate calculele au fost efectuate folosind logaritmi, cinci cifre sau patru cifre. Cantitatea calculată de substanță cîntăresc numai pe o balanță analitică.
Ponderarea se realizează, sau pe o sticlă de ceas, sau într-o sticlă de cântărire. Se toarnă materialul cântărit spălat într-un balon cotat pur printr-o pâlnie curat, uscat, în porțiuni mici. Apoi, de la o spălare de mai multe ori cu porțiuni mici de apă spălate peste sticlă pâlnie bnzhe sau ore, care au fost cântărite. Palnie și se spală cu apă distilată la o spălare de mai multe ori.
Pentru oversleeping cristale solide sau pulberi într-un balon cotat foarte convenabil de a utiliza pâlnia prezentată în Fig. 349. O astfel de pâlnie container fabricat 3, 6 și 10 cm3. Poate fi cântărit direct mostră din aceste pâlnii (materiale neabsorbante) care determină în prealabil masa lor. Linkage pâlniei este foarte ușor transformată într-un balon cotat. Când cântărit se toarnă, pâlnie fără a scoate din gâturile balonul este bine spălat cu apă distilată, dintr-o sticlă de spălare.
In general, la prepararea soluțiilor și traducerea exactă a solutului în balon volumetric solvent (de exemplu apă) nu trebuie să dureze mai mult de jumătate din capacitatea flaconului. retorta scuturat până la dizolvarea completă a solidului. După aceea, soluția rezultată este suplimentată cu apă la semn și se amestecă bine.
Soluții Molar. Pentru a prepara 1 litru de soluție a unei substanțe 1 M este cântărit pe o balanță analitică și ei 1 mol a fost dizolvat așa cum este descris mai sus.
Exemplu. Pentru a prepara 1 litru de soluție 1 M de nitrat de argint sunt numărate într-un tabel sau o greutate moleculară de AgNO3, este egală cu 169.875. Sarea a fost cântărite și dizolvate în apă.
Dacă este necesar să se prepare o soluție diluată mai (0,1 sau 0,01 M), a fost cântărit, 0,1 sau 0,01 moli de sare.
Dacă este necesar să se prepare 1 litru de soluție de mai puțin dizolvat, respectiv, într-o cantitate minimă de potrivire a ecranului apa sarata.
soluții normale sunt preparate în mod similar, nu numai otveshivaya 1 mol și 1 gram solid echivalent.
Când amestecarea sau soluție decinormal seminormal preluate de 0,5 sau 0,1 grame echivalent. Când nu se prepara 1 litru de soluție, și mai puțin, cum ar fi 100 sau 250 ml, apoi berut1 / 10, sau 1/4 din cantitatea de substanță care este necesară pentru prepararea I l, și se dizolvă într-un volum corespunzător de apă.
Figura 349. Pilnie pentru oversleeping și balon probă.
După prepararea unei soluții a acestuia, este necesar să se verifice soluția de titrare corespunzătoare cu o altă substanță cunoscută normalitatea. Soluția preparată nu poate satisface exact normalitatea pe care este definită. În astfel de cazuri, corecția se administrează uneori.
Calcul în prepararea titrant pentru analit sunt de asemenea gram-echivalent solutului, utilizând formula:

Exemplu. Să presupunem că este necesar pentru a prepara 3 L soluție de permanganat de potasiu, cu un titru de fier 0,0050 g / ml. Gram-echivalent KMnO4 este 31,61. și gram-echivalent de Fe 55847.
Calculat prin formula de mai sus:
Soluții standard. Soluțiile standard au fost numite cu diferite concentrații, bine definite utilizate în colorimetrie, de exemplu soluții conținând 1 ml de 0,1, 0,01, 0,001 mg, și așa mai departe. D. solute.
In plus testul colorimetric, astfel de soluții sunt necesare pentru determinarea pH-ului la determinările nefelometrice etc. soluții Uneori standard „depozitate în fiole sigilate, dar de multe ori trebuie să le gătească imediat înainte de utilizare soluții standard sunt preparate într-un volum de maximum 1 l, și slit cha .. - mai puțin. Numai atunci când un consum mare de soluții standard pot fi preparați câțiva litri de ea, și apoi cu condiția ca soluția standard nu vor fi stocate pe termen lung.
Cantitatea de substanță (în grame) necesară pentru a obține astfel de soluții se calculează cu formula:

Exemplu. Trebuie să pregătiți soluții standard de CuSO4 • 5H2O pentru determinarea colorimetrică a cuprului, și 1 ml din prima soluție trebuie să conțină 1 mg de cupru, al doilea - 0,1 mg, 0,01 mg a treia, a patra - 0,001 mg. pregăti inițial o cantitate suficientă din prima soluție, cum ar fi de 100 ml.
În acest caz, Mi = 249,68; ASu = 63,54; prin urmare, pentru prepararea 100 ml soluție, 1 ml, care ar conține 1 mg de cupru (T = 0,001 g / ml), este necesar să se ia
O probă cântărită de sare a fost transferată într-un balon cotat și se adaugă 100 ml de apă la semn. Alte soluții sunt preparate prin diluarea fierte în mod corespunzător.
Soluții empirice. Concentrația acestor soluții adesea sunt exprimate în g / l sau g / ml. Pentru prepararea soluțiilor utilizate empiric purificate prin substanțe de recristalizare sau reactivi ore de calificare. D. A. sau x. h.
Exemplu. Este necesar să se prepare o soluție CuSO4 de 0,5 litri, care conțin de Cu 10 mg / ml. Pentru a prepara soluția utilizată CuSO4 • 5H2O.
Pentru a calcula cât de mult ar trebui să ia această electr./solar pentru prepararea unui volum predeterminat de soluție este considerat ca Cu ar trebui să fie conținute de acestea. La acest volum este înmulțită cu concentrația predeterminată, t. E.
500 * 10 = 5000 mg, sau 5.0000 g
Apoi, cunoscând greutatea moleculară a sării, este numărat numărul dorit:
Pe o balanță analitică într-un flacon de cântărire se cântăresc cu precizie 19.648 g de sare pură, este convertită într-un balon cotat de 0,5 l. Dizolvare a fost realizată așa cum este descris mai sus.