Cum se utilizează tabelul periodic
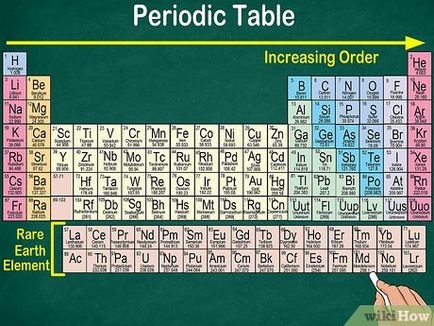

- Nu fiecare rând sau coloană are un set complet de elemente. Chiar dacă în centrul mesei sunt celule goale, layout-ul continuă de la stânga la dreapta. De exemplu, hidrogenul are numărul atomic 1 și este situat în colțul din stânga sus. Heliul are un număr atomic 2 și este situată în colțul din dreapta sus.
- Elementele cu număr atomic de la 57 la 103, în general, reprezentate separat în partea de jos a tabelului. Ele sunt „elemente de pământuri rare“.
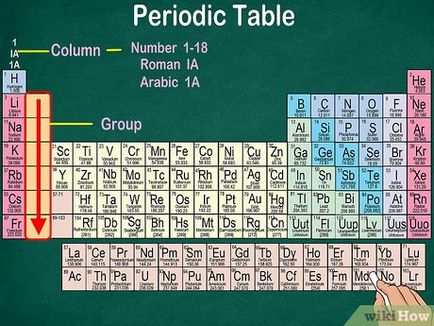

- Grupurile citit de sus în jos.


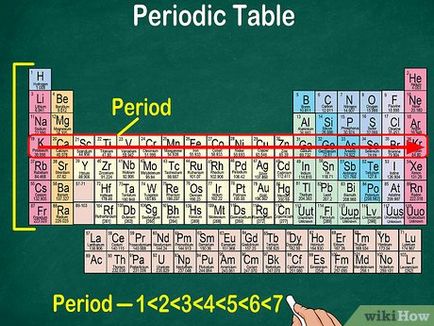

- Numerotarea perioadelor (1 la 8) este prevăzut pe partea stângă a tabelului.
- Fiecare perioadă ulterioară de mai mult decât anterior. Acest lucru se datorează unei creșteri a nivelului de energie de atomi.
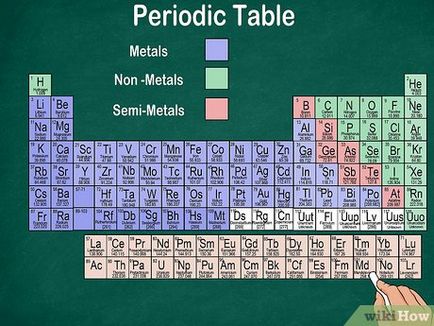

- celulă metal vopsit într-o anumită culoare. Metale - elementele cu proprietăți metalice caracteristice: luciu, conductivitate termică, conductivitate electrică, ductilitate, rezistență mare, în stare solidă (de obicei) la temperatura camerei.
- Cell nemetale sunt vopsite într-o anumită culoare diferită. Elemente It C-6 și Rn-86, inclusiv H-1 (H). Metaloizi nu sunt strălucească, nu efectuează căldură sau electricitate și nu falsificate. La temperatura camerei, nemetale sunt într-o stare solidă, lichidă sau gazoasă.
- celule semimetale pictat o anumită culoare în a treia. Semimetale sunt aranjate în diagonală între metale și nemetale. Elementele It B-5 prin At-85. Ele prezintă unele proprietăți ale ambelor metale și nemetale. [1]
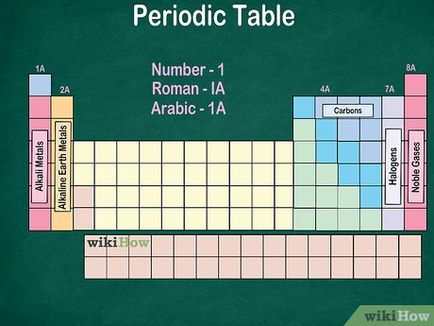

- Numerotarea poate fi roman sau araba.
Partea a 2 din 4: Numele și simbol al elementelor dreptului
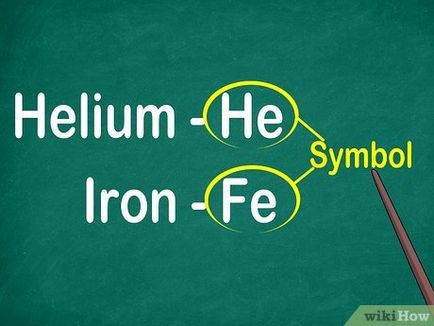

- Simbolul - este o abreviere a numelui latin al elementului, de exemplu, Fe (fier) din Ferrum Latin.
- Pentru a gasi rapid elementele din tabel trebuie să vă amintiți de caractere lor. [2]


Uită-te la numele elementului. Este afișată direct sub simbolul elementului. Numele elementului se va schimba în funcție de limba în care a publicat sistem periodic.
Partea 3 din 4: Numărul atomic al elementului citare
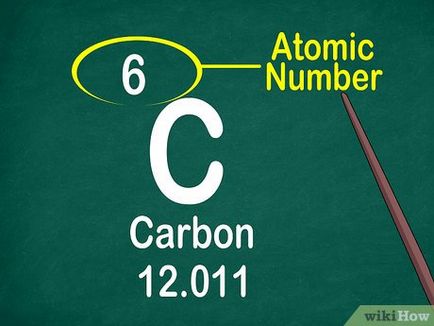

Numărul atomic este numărul de ordine al elementului în tabel; în fiecare celulă, este afișată în partea centrală de sus sau de sus stânga. Numărul atomic oferă informații suplimentare despre elementul.
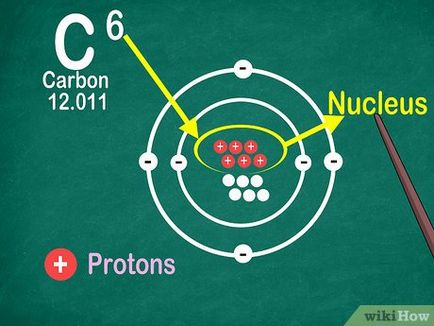

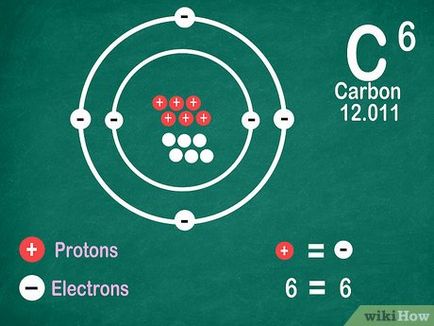
Notă: numărul atomic egal cu numărul de protoni din nucleul elementului atomului.
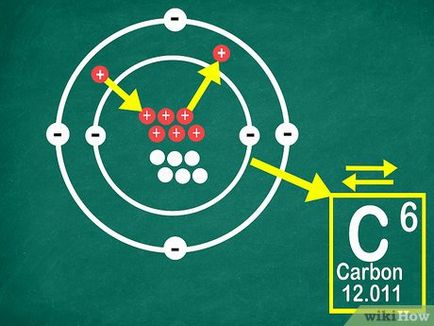

Notă: adunarea sau scăderea obținut protoni un alt element. [3]

- Rețineți că există o excepție de la această regulă. Dacă un atom pierde sau câștigurile electroni, acesta devine încărcat electric ion.
- În cazul în care elementul următor cu simbolul afișat plus ionul element este încărcat pozitiv, și, dacă este negativ, ionul este încărcată negativ.
- În cazul în care simbolul de lângă nimic nu este afișat elementul (fie plus sau minus) și în ionii problemă chimice nu sunt luate în considerare, numărul de protoni și electroni sunt probabil la fel.
Partea 4 din 4: Element de masă atomică Editare


- Poate părea că greutatea atomică în creștere de la începutul mesei (colțul din stânga sus), la capătul (colțul din dreapta jos); dar nu este.


Cea mai mare greutate atomică reprezentate ca numere zecimale, deoarece greutatea atomică - este o medie ponderată a maselor diferiților izotopi ai unui element.
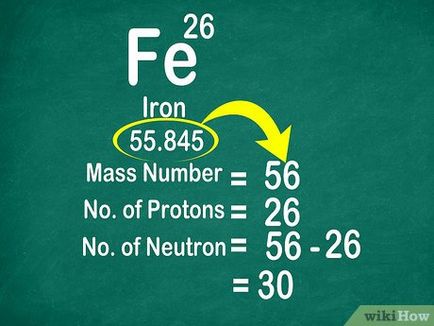
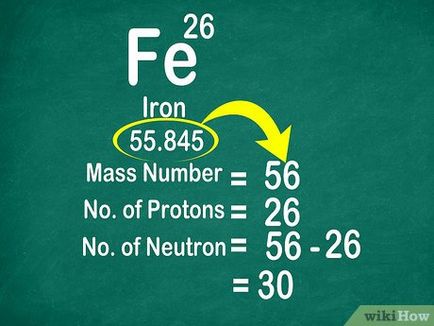
- De exemplu, greutatea atomică a fierului este egal cu 55.847, deci este egal cu numărul de masă al atomului 56. Fierul 26 protoni. 56 (numărul de masă) -26 (protoni) este 30. Într-un atom de fier de 30 de neutroni.
- Modificarea numărului de neutroni per atom conduce la izotopi care sunt mai grele sau mai ușoare decât elementul atomului.
articole suplimentare
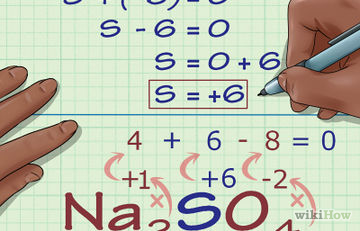
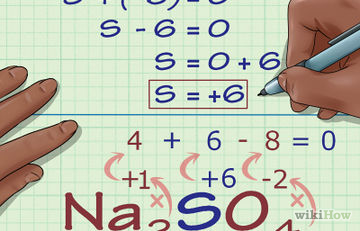
Cum se determina gradul de oxidare


Cum de a găsi numărul de protoni, neutroni și electroni
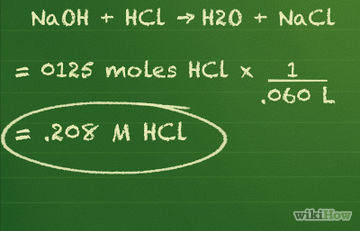

Cum se calculează concentrația soluției

Cum sa faci gheata uscata


Cum pot stoca gheata uscata

Cum acidifierea solului


Cum de a calcula molaritatea soluției


Cum să treci examenul în chimie


Ca amoniac Neutralizare

Cum de a determina electroni de valență