Sare - clasificarea, pregătirea și proprietăți
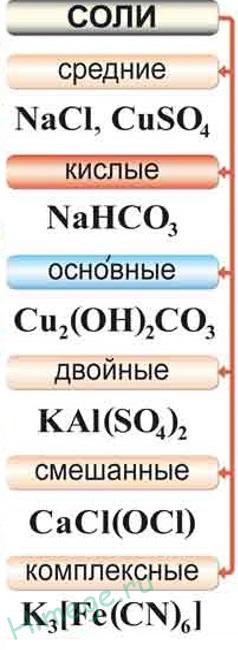
Sărurile numite mediu produse de înlocuirea completă a atomilor de hidrogen din molecula, atomii de metal acide sau înlocuirea completă a bazelor din resturile de acid gidroksogrupp moleculă.
De exemplu, H3 PO4 - Na3 PO4;
Cu (OH) 2 - CuSO4.
Sărurile acide sunt numite produse de substituție incompletă a atomilor de hidrogen din moleculele atomii metalici ai acizilor polibazici.
De exemplu, H2 SO4 - NaHSO4,
H3 PO4 - AN2 HPO4 - NaH2 PO4.
Sărurile bazice sunt numite produse de baze incomplete mnogokislotnyh gidroksogrupp substituția resturilor acide.
De exemplu, Ca (OH) 2 - CaOHCl;
Fe (OH) 3 - Fe (OH) 2 Cl - FeOHCl2.
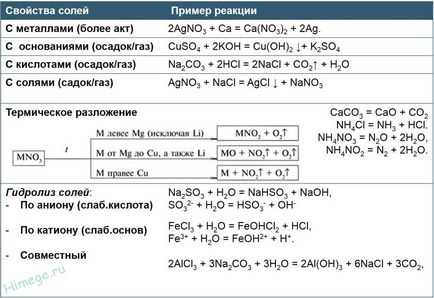
Sărurile acide reacționează cu alcalii pentru a forma săruri de mediu.
KHCO3 + KOH = K2 CO3 + H2O
Unele săruri acide, de exemplu, acidul carbonic se descompune sub acțiunea acizilor puternici:
KHCO3 HCI + = KCl + CO2 + H2O
Sărurile bazice reacționează cu un acid:
Cu (OH) Cl + HCI = CuCl2 + H2O
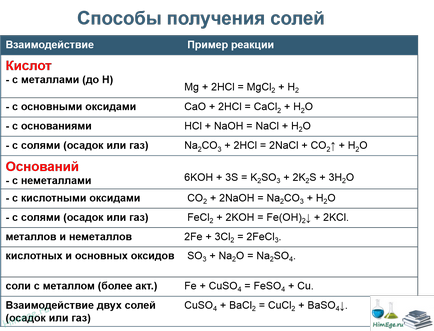
Proprietățile sărurilor complexe (săruri complexe metode de rupere)
1) Sărurile complexe reacționează cu acizi puternici, produșii de reacție depind de raportul dintre reactanți. Sub acțiunea unui exces dintr-un acid puternic obținut două ridicat de sare și apă. Acțiunea lipsei unui acid puternic obținut sare medie de metal activ, un hidroxid amfoter și apă, de exemplu:
2) La încălzire săruri complexe pierde apa:
3) Atunci când acțiunea dioxidului de carbon, dioxid de sulf sau sare sulfurat obținut hidrogen și hidroxid de metal activ amfoter:
4) Atunci când acțiunea sărurilor formate cu cationi de Fe 3+. Al 3+ și Cr 3+ hidroliză întărire reciprocă obținut două hidroxid amfoter și sare metalică activă: