Sare - Enciclopedia chimică
SALT. clasă de chimice. compuși. acceptat Universally definiția „săruri“, precum și termenii „acizi și baze“, produse de interacțiune. la-ryh sare este în prezent inexistentă. Sărurile pot fi considerate produse de substituție de protoni de hidrogen la-vă pentru ionii metalici și alți cationi sau grupări OH pe anioni de bază la-t (de exemplu, Cl - ,.) .. Produsele de substituție de mediu complet sunt săruri, de ex. SO4 Na2. MgCI2. incompletă - sare acidă sau bazică, de ex. KHSO4. CuClOH. O distincție este, de asemenea, sare simplă care cuprinde un tip de cation și o specie de anioni (de ex. NaCl), o sare dublă care conține două tipuri de cationi [de ex. KAl (SO4) 2 · 12H2 O], sărurile amestecate în compoziția pentru formarea resturilor de acid două ryh (de ex. AgClBr). Sărurile complexe (vezi. Compusul de coordonare) cuprind ioni complecși. de ex. K4 [Fe (CN) 6]. T. numit. săruri interne, de ex. Betaina (CH3) 3 NCH2 COO -. sunt ionii bipolare.
Sărurile tipice -kristallich. Insulele din structura de ioni, de ex. CsF (vezi. Legătura ionică. Cristale ionice). Există, de asemenea, săruri covalente, de exemplu. A1Sl3 (a se vedea. Cristale covalente). De fapt, natura produsului chimic. Comunicarea între mai multe săruri - mixte. Pe reguli nume formează săruri se referă. Nomenclatura chimică.
Pentru p-rimosti distinge solubil în apă, puțin solubil și sărurile substanțial insolubile. Pentru p - solubil includ aproape toate de sare de sodiu. potasiu și amoniu. pl. nitrați. acetați și cloruri. cu excepția sărurilor de metal polivalent. hidroliză în apă. pl. sare acidă.
In sare apoasa p pax disocia complet sau parțial în ioni (vezi. Disociere electrolitica). Sărurile slabe la-t, și (sau) sunt supuse unor baze slabe cu hidroliză. Sărurile de apă ale p-riu conțin hidratat. ioni (vezi. Hidratarea), perechi de ioni și chimice mai complexe. forme, inclusiv produse de hidroliză și altele. Un număr de săruri sol. De asemenea, în alcooli. acetonă. amide k-m și colab. Org. p-celeration.
Din sare apoasă p-moat poate cristaliza în formă cristalină (a se vedea. Hidrați) a unui solvați neapoase-cristal. de ex. SaVr2 H5 OH · 3C2 (vezi. Solvații). Sărurile de interacțiune P-riu. cu metale. Potențialele de electrod standard pentru a-ryh mai negativ decât potențialul de metal. este parte a sării:
Deoarece sărurile p-bine solubil de slab la puternic peste -t- să se deplaseze mai slab:
Deoarece sărurile p bine solubile ale bazelor slabe, stramuta mai puternic p-bazic solubil mai slabe:
In sistemele apoase, pot să apară sarea dintre săruri de schimb p-TION, prelucrează săruri greu solubili sau complecși ai:
Date privind în dec. procesele care apar într-o sisteme apoase de sare de săruri p rimosti la prezența lor comună, în funcție de m-turii, presiune și concentrare. compoziția fazelor solide și lichide, m. b. obținute prin studierea diagramelor rimosti sistemele p-apă-sare (Figura 1, 2,., a se vedea, de asemenea, analiza de soluții fizicochimic ..).
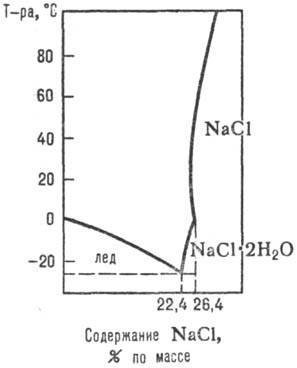
Fig. 1. Diagrama de sisteme p-rimosti NaCl-H2O
Metode generale de sinteză a sărurilor. Interacțiunea. k-m și bază (p-TION de neutralizare ur-1.), iar la t oxizilor de bază (2) și baze cu oxizi acizi (3) sau oxizii acizi și bazici (4):
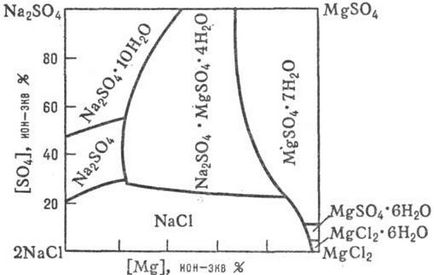
Fig. Figura 2. p-rimosti sistem "mare" 2NaCI + MgSO4 MgCl2 + Na2 SO4 în apă la 25 ° C
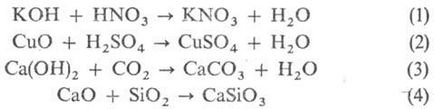
Trebuie remarcat faptul că produsele de interacțiune. baze și la Lewis-t (cm. Acizi și baze) diferă de săruri convenționale în raport cu acestea se utilizează referințe. "Complex acid-bază" sau "aduct". schimb de interacțiune. între k-lea și sare sau sare bazică a acestuia și (5.6):
Materia primă pentru bal. obținerea unui număr de săruri de clor, sulfați. carbonați. borate Na, K, Ca, Mg sunt marine și oceanice. apă. p. saramuri, format atunci când se evaporă. și depuneri solide de săruri (vezi. Galurgiya). Pentru grupul de minerale. formând o sare depozit sedimentar (sulfați și cloruri de Na, K și Mg), titluri condiționate aplicabile. „Sare naturala.“ Naib. mari depozite de săruri de potasiu se găsesc în România (Solikamsk), Canada și Germania, puternic minereu depozite de fosfat, în Africa de Nord, România și Kazakhstan, NaNO3 -B Chile.
Sărurile utilizate pishch. Chem. metalurgice. sticlă, piele, textile de bal stimul, în câteva secunde. x-ve, medicină și așa mai departe. d.
Lit. Posin M. E. Tehnologia sărurilor minerale, a 4-a ed. 1 -2 h, L. 1974 .; Fundații Batsanov SS experimentale ale structurale Chimie. M. 1986, p. 195-226; Ksenzenko VI Kononova G. N. Bazele teoretice ale proceselor de prelucrare a materiilor prime halurgy, M. 1982, p. 11-211. VP Danilov.
